Un commento sui risultati di due studi clinici di fase 3, recentemente pubblicati, su efficacia e sicurezza di Trikafta in persone con FC, sia con doppia che con singola mutazione F508del.
La storia dei farmaci modulatori della proteina CFTR mutata inizia nei primi anni del 2000, con crescenti contributi di ricerca di varia provenienza, tra cui quelli importanti di gruppi italiani, tuttora molto attivi in questo campo. Le conoscenze così maturate sono state la base di un processo di sviluppo messo in atto prevalentemente da una piccola azienda farmaceutica (Vertex) che nel 2012 arrivò a concludere uno studio clinico su un composto, l’ivacaftor (Kalydeco), che si rivelò fondamentale nel recupero della funzione CFTR in soggetti FC con almeno una copia della mutazione G551D (interessa il 4-5% dei malati FC). Questa mutazione, come altre della stessa classe III, è causa di una forte riduzione dei tempi di apertura del canale CFTR, presente ma difettoso sulla membrana apicale degli epiteli. Ivacaftor fu definito “potenziatore”, perché consentiva al canale CFTR mutato di incrementare la sua funzione di facilitare lo ione cloro a fluire attraverso la membrana apicale degli epiteli, equilibrando efficacemente le caratteristiche di scorrimento delle secrezioni di molti organi e consentendo altresì il recupero del cloro e del sodio dal condotto escretore delle ghiandole sudoripare (test del sudore). Sul piano clinico, anche dopo anni di impiego, quel potenziatore si è rivelato determinante nel migliorare lo stato di salute di una frazione di malati e il suo impiego è stato esteso ad altre mutazioni con simile difetto (altre mutazioni di gating o di classe III) e lo sarà probabilmente anche per mutazioni a funzione residua (classi IV e V).
L’interesse prevalente della ricerca da quasi 20 anni è stato quello di affrontare la mutazione F508del che, in singola o doppia copia, riguarda la stragrande maggioranza dei malati FC. Questa mutazione impedisce il ripiegamento (folding) e il trasferimento (trafficking) della proteina canale CFTR verso la sua sede di azione, la membrana apicale delle cellule epiteliali. Fin dagli inizi si capì che questa proteina mutata poteva essere aiutata a raggiungere la membrana sia con mezzi fisici (bassa temperatura) sia con mezzi chimici di varia natura. La gara per identificare i mezzi clinicamente utilizzabili allo scopo ha portato già da parecchi anni alla proposta di piccole molecole, chiamate “correttori”, ai quali si doveva aggiungere un potenziatore perché il canale CFTR, recuperato alla sede di azione, manteneva un suo difetto di apertura. Il primo correttore arrivato agli studi clinici è stato il Lumacaftor che, combinato con il potenziatore ivacaftor nella formulazione chiamata Orkambi, ha dato qualche risultato ma clinicamente poco significativo (incremento medio di FEV1 2,6%) e tuttavia sufficiente a fornire la prova di principio che la proteina CFTR-F508del era curabile. Un po’ meglio una successiva combinazione (correttore tezacaftor + potenziatore ivacaftor), posta sul mercato nel 2018 e chiamata Symdeco/Symkevi: incremento medio di FEV1 del 4% nei trial clinici. Con entrambe queste combinazioni il cloro nel sudore, spia della funzione CFTR, diminuiva modestamente.
Per superare le limitazioni di questi primi approcci di combinazione correttore + potenziatore si è arrivati alla convinzione che occorreva associare due correttori che agissero in sinergia su punti diversi del percorso di maturazione di CFTR-F508del. Negli ultimi anni ci si è cimentati in piccoli studi clinici con diverse combinazioni di correttori di diversa generazione. Gli ultimi trials clinici di fase III, conclusi nella primavera 2019, hanno riportato risultati molto interessanti con due combinazioni: [VX-659 + tezafactor + ivacaftor] e [VX-445 + tezacaftor + ivacaftor] (1). Entrambe le combinazioni hanno ottenuto sensibili incrementi di FEV1% e importanti riduzioni di concentrazione del cloro nel sudore (segno che l’effetto clinico riscontrato era associato a un sostanziale recupero della funzione CFTR). L’azienda Vertex, promotrice di questi studi, ha scelto la combinazione [VX-445 (elexacaftor) + tezacaftor + ivacaftor] per sottoporla all’approvazione dell’agenzia USA FDA, approvazione concessa verso la fine di ottobre 2019, con successiva messa in commercio per i malati della popolazione statunitense.
Questa premessa ci permette di accostare per sintesi i due studi che hanno consentito di ottenere l’approvazione FDA della tripla combinazione elexacaftor-tezacaftor-ivacaftor, commercialmente denominata Trikafta.
Trial su malati omozigoti F508 del
Il primo studio (2 ), randomizzato, controllato, in doppio cieco, è disegnato “per superiorità” (valutare l’effetto di un intervento terapeutico nei confronti di un altro, con l’ipotesi che il primo sia superiore), condotto su 107 soggetti FC omozigoti F508del di 12 o più anni: 55 nel gruppo di combinazione elexacaftor-tezacaftor-ivacaftor; 52 nel gruppo controllo. Il FEV1 di partenza variava dal 40 al 90%. Tutti gli arruolati avevano ricevuto, dopo 4 settimane (periodo detto di screening) dedicate alla selezione e alla verifica di stabilità clinica, un trattamento di 4 settimane con tezacaftor-ivacaftor (Symdeko). Questo pretrattamento (chiamato run-in period) con Symdeco di entrambi i gruppi è giustificato dagli autori con l’opportunità di non privare i malati di un trattamento che già era entrato nello standard di cura della fibrosi cistica e per mettere i due gruppi nella stessa posizione di partenza. In seguito, per 4 settimane, il gruppo con triplo farmaco riceveva una dose fissa, costituita da elexacaftor 200 mg + tezacaftor 100 mg + ivacaftor 150 mg al mattino e dal solo ivacaftor 150 mg la sera. Il gruppo di controllo riceveva placebo (falso elexacaftor) + tezacaftor 100 mg + ivacaftor 150 mg al mattino e ivacaftor 150 mg la sera. Tutti gli arruolati hanno completato lo studio e sono stati eletti poi per uno studio di estensione in aperto di 96 settimane con la triplice combinazione.
Di seguito, i risultati relativi ai parametri fondamentali, riportati nello studio.
Risultati di efficacia: Valori medi (tra parentesi, intervalli di confidenza al 95%)*
| End points | Placebo/TEZ/IVA
n 52 |
ELEX/TEZ/IVA
n 55 |
Diff. Rispetto a
Gruppo controllo |
| FEV1 (% predetto). Variazioni assolute
punti % dall’inizio, dopo 4 settimane |
+ 0,4
(-1,4 – 2,3) |
+10,4
(8,6 – 12,2) |
+10,0
(7,4 – 12,6) |
| Test sudore (variazioni cloruro) mmol/L | + 1,7
(-1,9 – 5,3) |
-43,4
(-46,9 – 40,0) |
-45,1
(-50,1 – -40,1) |
| Qualità vita: punteggio sintomi respiratori
(significative le variazioni oltre 4 punti) |
-1,4
(-5,4 – 2,6) |
+16,0
(12,1 – 19,9) |
+17,4
(11,8 – 23,0) |
* Gli intervalli di confidenza indicano l’entità di dispersione (variabilità) dei risultati: sono i valori minimi e massimi registrati nel 95% dei soggetti testati, dai quali sono esclusi il 2,5% degli estremi molto bassi e il 2,5% degli estremi molto alti.
Risultati di sicurezza. Eventi avversi si sono registrati nel 58% dei casi in triplice e nel 63% in duplice combinazione. Ma si è trattato nella quasi totalità dei casi di sintomi comuni dovuti alle complicanze preesistenti, tipiche della malattia (tosse o esacerbazione polmonare). In rari casi si è avuto modesta elevazione di transaminasi. Nessun caso è uscito dal trial a causa di tali eventi.
Trial su malati eterozigoti F508del con seconda mutazione con funzione minima
Il secondo studio (3) è un trial clinico controllato, randomizzato, in doppio cieco su pazienti di 12 o più anni con FEV1 di partenza compresa tra 40 e 90%. Riguarda pazienti eterozigoti composti per la mutazione F508del associata ad altra mutazione definita “con funzione minima”. Questo concetto di funzione minima starebbe a significare che si tratta di mutazioni che comportano mancata sintesi di CFTR o che da analisi in vitro non mostrano funzione CFTR o questa è inferiore al 10% della funzione normale. Per il reclutamento dei partecipanti, lo studio ha elencato 227 mutazioni di questo tipo, senza escluderne peraltro eventuali altre con simili caratteristiche: si tratta comunque di mutazioni che non rispondono in vitro alla combinazione tezacaftor-ivacaftor. In pratica sono tutte le mutazioni non-F508del, a esclusione di quelle che già rispondono a ivacaftor (Kalydeco), come le mutazioni di classe III e V.
Il gruppo con triplo farmaco riceveva una dose fissa, costituita da elexacaftor (200 mg) + tezacaftor (100 mg) + ivacaftor (150 mg) al mattino e dal solo ivacaftor (150 mg) alla sera. Il gruppo placebo riceveva al mattino il triplo placebo e alla sera il placebo falso ivacaftor. Nel complesso hanno portato a termine lo studio 403 soggetti FC: 200 nella tripla combinazione e 203 nel gruppo placebo. Tutti i pazienti che hanno portato a termine lo studio sono stati poi eletti per l’arruolamento in uno studio di estensione, aperto, con la tripla combinazione, della durata di 96 settimane. Lo studio è stato condotto in 115 centri di 15 stati (NordAmerica, Europa inclusa Italia, Australia). Di seguito i risultati essenziali.
Risultati di efficacia: Valori medi (tra parentesi, intervalli di confidenza al 95%)
| End points | Placebo
n 203 |
ELEX/TEZ/IVA
n 200 |
Diff. Rispetto a
Gruppo controllo |
| FEV1 (% predetto). Variazioni assolute
Punti % dall’inizio, dopo 4 settimane |
– 0,2
(-1,3 – 1,0) |
+ 13,6
(12,4 – 24,8) |
+13,8
(12,1 – 15,4) |
| FEV1 (% predetto). Variazioni assolute
Punti % dall’inizio, dopo 24 settimane |
– 0,4
(-1,5 – 0,7) |
13,9
(12,8 – 15,0) |
+ 14,3
(12,7 – 15,8) |
| Esacerbazioni polmonari 24 sett. (rip. a 1 anno) | 113 | 41 | – 63 % |
| Test sudore (variazioni cloruro) mMol/L
24 settimane |
– 0,4
(-2,2 – 1,4) |
– 42,2
(-44,0 – -40,4) |
-41,8
(-44,4 – 39,3) |
| Qualità vita: punteggio sintomi respir. 24 sett | – 2,7
(-4,6 – 0,8) |
+ 17,5
(15,6 – 19,5) |
+ 20,2
(17,5 – 23,0) |
| Rapporto peso/altezza2 (BMI) 24 sett. | + 0,09
(-0,05 – 0,22) |
+ 1,13
(0,99 – 1,26) |
+ 1,04
(0,85 – 1,23) |
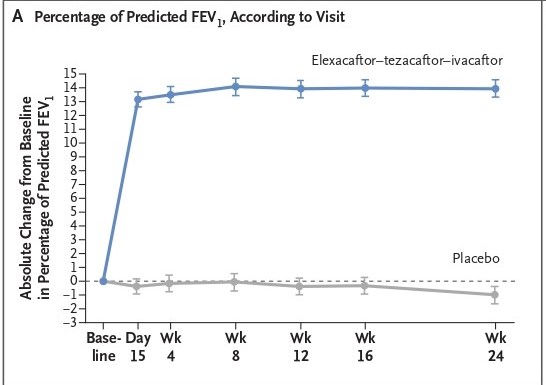
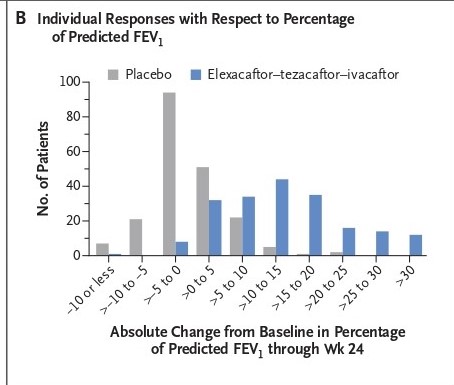
Le due figure che seguono si riferiscono al cosiddetto end point principale. In (A) le variazioni medie di FEV1% nel corso del trattamento con la triplice o con il placebo, dalla partenza alla fine di 24 settimane. Il guadagno medio di FEV1 è già evidente a 15 giorni e tale si mantiene fino alla fine. In (B) le risposte ai trattamenti sono suddivise in classi di FEV1%: i casi in placebo si concentrano tra valori che cadono sotto il -10% fino a valori che stanno tra +5 e 15%; i casi in trattamento con la triplice stanno quasi tutti tra 0 e oltre +30 punti percentuali di guadagno, ma una buona parte, soprattutto quelli che stanno tra 0 e +10% si sovrappongono alle variazioni registrate nei casi in placebo: sono circa 70 pazienti su 200 in tripla (35%) e circa altrettanti sui 203 in placebo che si sovrappongono per gli incrementi di FEV1. Le medie di differenza tra tripla e placebo, ovviamente, fanno giustizia di queste sovrapposizioni, separando fortemente i due gruppi.
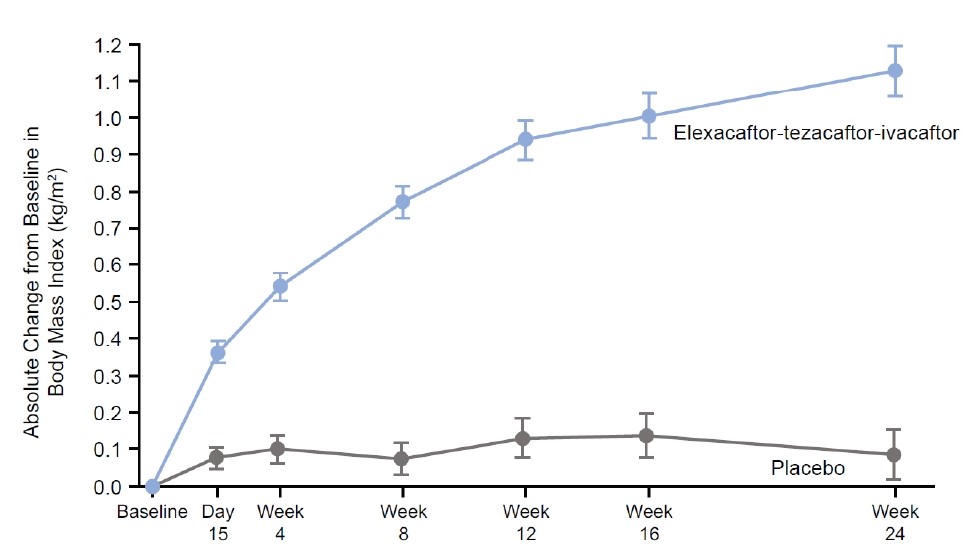
Nella figura (C) si osserva il crollo del cloro sudorale (che indica il sostanziale recupero di funzione CFTR) già a 4 settimane, oltre le quali si mantiene fino a fine trattamento sui valori medi di 60 mmol/L. In figura (D) è la curva di progressivo incremento dell’indice di massa corporea. La differenza con il placebo, a livello di medie, è rilevante. La pubblicazione e il suo supplemento correlato non descrivono la distribuzione delle risposte individuali con tripla e placebo.
C Test del sudore: variazioni medie del cloro in 24 settimane di D Indice di massa corporea (BMI = Peso/altezza2): variazioni
trattamento con tripla o placebo medie in corso di trattamento
È di interesse anche riportare l’andamento nei giorni del trial delle eventuali esacerbazioni respiratorie. Le curve della figura (E) descrivono, con una speciale elaborazione, il numero dei malati che nel tempo rimangono privi di esacerbazioni: spicca la differenza tra il gruppo in triplice e il gruppo in placebo.
E Numero di malati che nel proseguo del trial sono liberi da esacerbazioni respiratorie (Triplice vs placebo)
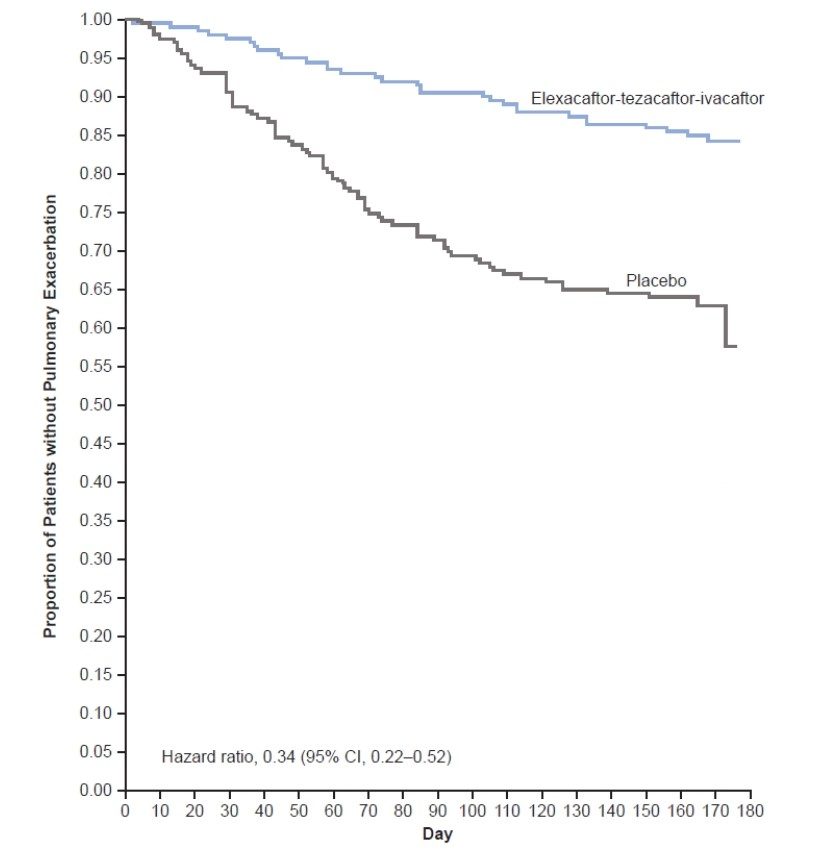
Le due curve descrivono in sostanza il graduale venir meno in 180 giorni di osservazione del numero di pazienti esenti da esacerbazioni (piccolo nel gruppo in triplice, più del doppio nel gruppo placebo). Ciò che separa nel grafico le due curve è il tempo che corre fino alla prima esacerbazione (molto più lungo nel gruppo triplice rispetto al placebo).
Risultati di sicurezza. In poco più del 90% in entrambi i gruppi si sono avuto eventi avversi: nella quasi totalità erano lievi o moderati e si sono risolti in breve tempo. Si è trattato quasi sempre di manifestazioni comuni della malattia (tosse, esacerbazioni polmonari), più frequenti peraltro nel gruppo placebo. Nell’11% dei soggetti in triplice si è avuta discreta elevazione di transaminasi, presente peraltro anche nel 4% dei soggetti in placebo. Alcuni casi hanno avuto rash cutaneo, con poca differenza tra triplice e placebo. Due casi hanno interrotto il trial nel gruppo triplice per eventi avversi ma nessuno nel gruppo placebo.
Commenti
Non vi è dubbio che il trattamento con la triplice combinazione elexacaftor-tezacaftor-ivacaftor si è mostrata francamente più efficace nei malati omozigoti F508del rispetto ai trattamenti correnti con lumacaftor-ivacaftor (Orkambi) e tezacaftor-ivacaftor (Symdeco/Symkevi). Può meravigliare che il guadagno di 10 punti in FEV1 % sia inferiore di 4 punti rispetto a quello ottenuto nei soggetti eterozigoti F508del (14%). In realtà tutti soggetti del primo trial avevano avuto un mese di pretrattamento con Symdeco e Kalydeco e pertanto si può ipotizzare che quei 4 punti di differenza fossero già stati guadagnati nel pretrattamento. I trial di fase III con tezacaftor-ivacaftor, infatti, avevano ottenuto un incremento medio di 4% di FEV1, all’incirca nello stesso tempo. La tolleranza nel breve periodo si è rivelata complessivamente buona. La breve durata del trial e la scarsa numerosità dei pazienti costituiscono una limitazione al significato dei risultati ottenuti e comunque questi appaiono sufficienti a testimoniare che la tripla combinazione è assai più vantaggiosa rispetto alle altre doppie combinazioni già introdotte nell’uso.
Con questo trial e con quello sugli eterozigoti si conferma la necessità di agire su punti diversi del percorso maturativo di CFTR-F508del, appunto con l’associazione di almeno due correttori, per correggerne a sufficienza la deviazione e ottenere una sufficiente presenza della proteina in membrana apicale cellulare, da attivare con un potenziatore.
Questa recensione si è intrattenuta più diffusamente sul trial condotto negli eterozigoti F508del perché è il più importante e più completo e fornisce dati inaspettati, che fanno concludere che è possibile con modulatori di CFTR recuperare clinicamente la funzione CFTR anche nei soggetti con una singola copia di F508del. L’impressione è che la seconda mutazione non abbia alcuna rilevanza nel recupero di funzione e che tutto l’effetto sia legato all’azione della triplice combinazione sulla proteina codificata dalla mutazione F508del. Possiamo infatti immaginare che il doppio correttore recuperi una quantità di proteina CFTR, anche se prodotta in metà dose rispetto agli omozigoti, sufficiente a recuperare una buona fetta di funzionalità del canale CFTR, avvicinandosi in qualche misura alla condizione dei portatori sani FC, che hanno un sola copia di mutazione CFTR normale e pertanto in essi una quota di 50% di funzione CFTR complessiva assicura uno stato di salute normale come nei soggetti con il 100% di funzione CFTR: sappiamo anche, da studi in vitro, che basta meno del 50% per ottenere un ragionevole equilibrio nel trasporto epiteliale del cloro e ciò sembra ottenersi con Trikafta negli eterozigoti F508del. E questa è una eccellente prova di principio, ottenuta in vivo, che questa è la strada da percorrere per eventuali miglioramenti dei modulatori per malati anche con singola mutazione F508 del.
Il trial sugli eterozigoti, tuttavia, merita di essere valutato anche nei suoi aspetti potenzialmente limitanti. Il valore medio di incremento di FEV1 del 14% è certamente un indicatore di forte efficacia, ma non possiamo ignorare che almeno il 30% dei pazienti trattati con la triplice ottiene incrementi anche parecchio inferiori alla media, incrementi che si ritrovano in simile percentuale nei soggetti che ricevevano placebo (si veda la figura B). Del resto, la variabilità di risposta a un farmaco si ritrova in tutti i trial clinici, quello che conta è riuscire a capire bene in quale misura si pone la probabilità di successo o insuccesso nei singoli soggetti. In questo tipo di studi l’analisi dei risultati individuali è pertanto molto importante, perché permette di predire la percentuale di probabilità di successo clinico che il trattamento può ottenere tra i malati candidati. E potrebbe anche profilarsi l’opportunità di pre-testare su modelli in vitro, come quello degli organoidi intestinali, il livello di risposta prevedibile alla triplice nel singolo individuo. Va anche detto che questi trial hanno incluso soggetti con diverso grado di malattia polmonare: il FEV1 di partenza variava dal 40% al 90%, e questo può almeno in parte spiegare la forte variabilità di risultati. Potremmo infatti immaginare che i soggetti con malattia polmonare più avanzata siano quelli che hanno ricevuto meno beneficio dal trattamento.
Si dice (anche nel commento degli autori) che questa triplice, ora approvata da FDA con il nome di Trikafta, potrebbe interessare fino al 90% delle persone con FC (omozigoti ed eterozigoti insieme) nel mondo. In realtà, la frequenza della mutazione F508del in molti paesi è più bassa, anche di molto, rispetto a quella che si ha nei paesi anglosassoni. In Italia, ad esempio, da dati del Registro FC 2015-2016, gli omozigoti F508del sono il 21,1% e gli eterozigoti composti con altra mutazione (ma diversa da mutazioni con funzione residua) sono il 39,3% (circa il 2% di questi hanno, come seconda, una mutazione di gating [classe III]). Vi sono poi il 7,9% di soggetti con genotipo F508del/mutazione con funzione residua. Ora sappiamo che sia le mutazioni di gating sia quelle con funzione residua possono già essere trattate, anche in singola copia, con ivacaftor (Kalydeco). In Italia quindi sono il 58,4% i pazienti che attualmente potrebbero essere trattati con il solo Trikafta.
Rimane quindi circa un 31,7% di pazienti che non hanno F508del, per i quali si dovrebbero fare alcune considerazioni di dettaglio. Una parte di questi hanno almeno una mutazione che consente presenza di CFTR sulla membrana cellulare (mutazioni di classe III, di gating, con tempi ridotti di apertura del canale CFTR) e un’altra parte hanno almeno una mutazione con funzione CFTR residua (mutazioni di classe V [ridotta ma non assente sintesi di CFTR normale]) o una rara mutazione di classe IV [ridotta ma non assente capacità di trasporto del cloro]). Questi tre tipi di mutazioni, che interessano insieme circa il 10% dei malati italiani che non hannoF508del sono tutti rispondenti in varia misura a ivacaftor (Kalydeco). Grosso modo quindi, si potrebbe ipotizzare che in Italia, qualora si arrivasse a trattare tutti i pazienti suscettibili oggi di trattamento (compresi i lattanti) con i migliori modulatori di CFTR oggi esistenti (Kalydeco e Trikafta), circa il 68,4% (58,4 + 10%) dei malati FC potrebbero accedere a tali trattamenti. Per gli altri 31,6% la soluzione è affidata a una già impegnatissima ricerca.
Questi numeri obbligano in un prossimo futuro a elaborare una strategia articolata di intervento con modulatori CFTR. Inoltre, al momento, bisogna considerare che i trial clinici che hanno permesso negli USA l’autorizzazione al commercio di Trikafta si riferiscono a pazienti di 12 o più anni. Si attendono pertanto studi che riguardino soggetti di età inferiori, ben sapendo che l’efficacia clinica complessiva di Trikafta sarà tanto maggiore quanto più precoce l’avvio del trattamento, possibilmente dal momento della diagnosi, prima che danni irreversibili ne compromettano almeno in parte l’efficacia.
Queste considerazioni permettono anche di pensare che, pur potendo già disporre in tempi ragionevoli di questi nuovi farmaci, la strada della ricerca è ancora lunga e di questa si possono indicare già alcune direzioni: 1) testare la triplice, uscita da questi trial (studi di efficacia e sicurezza) in età gradualmente inferiori; 2) sviluppare combinazioni alternative di modulatori (acquisendo anche migliori conoscenze sui meccanismi d’azione e d’interazione dei correttori associati), sia per migliorarne l’azione, sia per contribuire a moderarne i costi, al fine di rendere i nuovi farmaci accessibili a tutti; 3) avviare studi di fase IV per monitorare nel medio e lungo termine le risposte ai farmaci modulatori, in termini sia di efficacia clinica che di tolleranza; 4) aprire la strada a correttori per mutazioni rare, di cui ancora poco conosciamo; 5) sviluppare ricerche, in parte già avviate, per agire su fronti diversi, indipendenti da mutazioni CFTR (es. canali alternativi del cloro) e, più radicalmente, sulla modifica del DNA genico o anche del RNA di trascrizione.
1) Incoraggianti risultati dagli studi clinici di fase III con la tripla combinazione VX-445 + tezacaftor + ivacaftor. Da report Vertex, Sito FFC: Progressi di ricerca. 3 Giugno 2019.
2) Heijerman HGM, McKone EF, Downwy DG, et Al. Efficacy and safety of the elexacaftor plus tezacaftor plus ivacaftor combination regimen on people with cystic fibrosis homozygous for te F508del mutation: a double-blind, randomized, phase 3 trial. Lancet 2019 October 31 (Epub ahead of print).
3) Middleton PG, Mall MA, Drevìnek P, et Al. Elexacaftor-Tezacaftor-Ivacaftor for Cystic Fibrosis with a Single Phe508del Allele. N Engl J Med 2019; published oinline Oct 31. DOI:10.1056/NEJMMoa1908639.