Recensione di pubblicazione da progetto FFC
I progetti FFC 3/2009 e 5/2012, coordinati da Nicoletta Pedemonte del Laboratorio di Genetica Medica dell’Istituto G. Gaslini di Genova, hanno come obiettivo lo studio di possibili nuove strategie di recupero della proteina CFTR derivata dalla mutazione F508del, la più frequente tra i pazienti FC. Essa determina la mancanza dell’aminoacido fenilalanina in posizione 508 all’interno di CFTR che risulta così più instabile ed è in massima parte degradata ed eliminata prima di maturare completamente e di pervenire alla membrana apicale delle cellule; la piccola quota che riesce a raggiungere la membrana non funziona adeguatamente come canale, mostrando un difetto di gating (apertura).
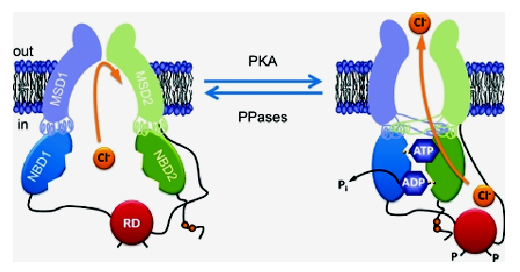
Da un punto di vista strutturale CFTR è costituita da cinque domini (unità), due domini attraversano la membrana cellulare e fanno da canale, due rimangono all’interno della cellula e interagiscono fra di loro, fornendo energia per l’apertura del canale; si può pensare a un quadrifoglio, ogni foglia rappresenta uno di questi quattro domini e il passaggio degli ioni cloro avviene attraverso il canale che si forma tra le due foglie transmembrana (vedi figura sotto). Il quinto dominio (RD nella figura) agisce da regolatore. Gli studi hanno evidenziato che alcune molecole, come i cosiddetti potenziatori, si legano direttamente alla struttura di CFTR, mentre altre, ad esempio i correttori, possono legarsi alla proteina ma anche agire sull’ambiente che accompagna la sua maturazione, senza un legame specifico con CFTR, stabilizzando un singolo dominio della proteina e/o l’interazione tra i domini.
I ricercatori coordinati dalla Dott. Pedemonte hanno deciso di studiare i meccanismi con i quali la mutazione F508del arresta la maturazione e la migrazione sulla membrana della proteina CFTR. A questo scopo si sono avvalsi di una tecnologia chiamata interferenza genica mediata da RNA (siRNA). Utilizzando questi siRNA, che sono piccole molecole a base di RNA, è possibile spegnere selettivamente un gene per volta e quindi la proteina che produce.
In una recente pubblicazione (1) si mostrano i risultati ottenuti applicando la tecnica di siRNA a cellule epiteliali bronchiali di origine umana che portano la mutazione F508del, quando venivano selettivamente silenziati alcuni geni e relative proteine, paragonando gli effetti al campione di controllo con la CFTR normalmente sintetizzata. È stata utilizzata una libreria contenete 6.550 geni che codificano per piccole proteine attive all’interno della cellula.
In questo modo sono state identificate 37 nuove proteine, la cui soppressione provoca un significativo recupero di CFTR mutata in cellule epiteliali bronchiali umane. Sono proteine associate alla degradazione di F508del, fattori di trascrizione, che hanno lo scopo di avviare la sintesi della proteina, e altre proteine di origine ignota. Di particolare interesse è risultata una proteina, denominata FAU, di origine sconosciuta e ancora non caratterizzata: silenziare l’85% di FAU significava recuperare il 65% di maturazione della F508del. Viceversa la presenza di FAU, oltre a degradare la proteina mutata, inibisce il funzionamento, già di per sé scarso, della piccola quota di proteina mutata che è sfuggita alla degradazione.
Il lavoro è articolato e molto ricco di informazioni. Gli autori hanno valutato quanto combinando il silenziamento dei bersagli proteici con il trattamento con il correttore VX-809 (Lumacaftor) si avesse un effetto sinergico: cioè il recupero della funzione CFTR era maggiore con questa combinazione rispetto ai singoli composti da soli. Gli autori si sono domandati fino a che punto la soppressione di più di una delle proteine analizzate risultasse in un effetto additivo. Al momento hanno analizzato in dettaglio solo la proteina FAU in quanto risultata la più interessante e povera di studi e informazioni. Essi hanno anche valutato l’effetto di FAU su altre proteine trasportatrici di ioni diverse da CFTR, rilevando su queste nessun effetto significativo.
La conclusione dello studio è l’evidenza che un certo numero di proteine sono importanti per la maturazione della CFTR mutata, osservazione che apre la strada a possibili specifici interventi terapeutici su queste proteine. La ricerca ha permesso di identificare un target particolarmente significativo, la proteina FAU, che potrebbe permettere di svelare nuovi meccanismi alla base della sintesi e maturazione proteica e offrire nuove strade terapeutiche per recuperare la funzione della CFTR mutata.
I progetti FFC 3/2009 e 5/2012 sono stati coordinati da Nicoletta Pedemonte del Laboratorio di Genetica Medica, Ist. G. Gaslini di Genova. Hanno ricevuto il supporto di adozione da parte di Anna Iacomini, Gruppo di Sostegno FFC Rita Verona, Delegazione FFC di Como e Danone S.p.A
In this paper (1), supported by Grant No FFC #3/2009 and 5/2012 and coordinated by Nicoletta Pedemonte from Medical Genetics Lab (Inst. G. Gaslini, Genova), by means of a functional genomics approach based on the screening of a druggable genome library of short-interfering RNA (siRNA) molecules, the authors report the identification of novel proteins, whose suppression results in a significant F508del-CFTR rescue in bronchial epithelial cells of human origin. The identified targets include proteins associated to F508del-CFTR degradation, transcription factors and proteins with unknown function. To identify proteins associated with F508del-CFTR processing, the researchers used a high-throughput functional assay to screen a siRNA library targeting 6,650 different cellular proteins. They identified 37 proteins whose silencing significantly rescued F508del-CFTR activity, as indicated by enhanced anion transport through the plasma membrane. Particularly interesting is FAU, a yet uncharacterized fusion protein consisting of the ubiquitin-like protein fubi at the N-terminus and ribosomal protein S30 at the C-terminus. The results expand the panel of putative drug targets available for novel therapy strategies addressing F508del-CFTR mistrafficking and premature degradation.
1. Tomati V, Pesce E, Caci E, Sondo E, Scudieri P, Marini M, Amato F, Castaldo G, Ravazzolo R, Galietta LJ, Pedemonte N. High-throughput screening identifies FAU protein as a regulator of mutant cystic fibrosis transmembrane conductance regulator channel. J Biol Chem. 2017 Nov 20. pii: jbc.M117.816595. doi: 10.1074/jbc.M117.816595.